Ebollizione
L’ebollizione è il passaggio di una sostanza dallo stato liquido allo stato di vapore e la temperatura alla quale avviene è detta temperatura di ebollizione, ed il suo valore, per uno stesso liquido, dipende ovviamente dalla pressione esterna.
Aumentando la temperatura di un liquido la sua pressione di vapore aumenta. Quando il valore della pressione di vapore raggiunge il valore della pressione che spinge sulla superficie del liquido stesso (pressione esterna) il liquido bolle, cioè si ha la formazione di vapore non soltanto alla superficie del liquido, ma in tutta la massa.
Quindi la temperatura di ebollizione di un liquido è quella temperatura alla quale la tensione di vapore del liquido diviene uguale alla pressione atmosferica. Questa definizione spiega il perché la temperatura di ebollizione di un liquido varia con il variare della pressione.
Ad esempio: in alta montagna dove la pressione è minore che al livello del mare, l’acqua bolle a una temperatura inferiore ai 100°C. Un liquido può quindi bollire ad innumerevoli temperature perché innumerevoli sono i valori che la pressione esterna può assumere. Quando si parla di temperatura di ebollizione di un liquido senza fare riferimento alla pressione, si intende, convenzionalmente, che la pressione esterna sia P = 1 atm.
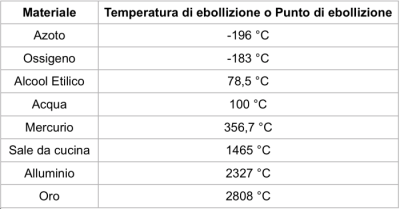
Per l’ebollizione di un liquido è necessaria la somministrazione di una certa quantità di calore che prende il nome di calore latente di ebollizione. In tabella sono riportate le temperature di ebollizione di alcuni tra i materiali più comuni: